一、荣登顶刊:JACS—— 化学与生物交叉领域的 “黄金标准”
本次研究成果发表于《美国化学会志》(Journal of the American Chemical Society, JACS),这是化学领域历史最悠久、影响力最顶尖的学术期刊之一(影响因子15.6),被誉为 “化学界的 Nature”。自 1879 年创刊以来,JACS 始终聚焦化学、材料、生物交叉领域的突破性创新,仅收录具有里程碑意义的原创研究,是全球科研工作者公认的学术高地。这是追光生物的DropletBot®数字微流控平台首次助力科研人员登上 JACS,标志着该技术在生物检测领域的创新性与先进性获得国际顶尖学术共同体的高度认可。

追光生物DropletBot®数字微流控平台
二、研究亮点:“双数字” 技术打破检测天花板,重塑超灵敏诊断格局
传统免疫检测技术常受限于灵敏度不足、背景干扰大、操作复杂等瓶颈,难以捕捉疾病早期极低浓度的生物标志物,成为早癌筛查、心血管疾病预警等领域的 “拦路虎”。 科研人员创新性地提出 “双数字”(Dual-Digital)检测策略,将 DropletBot®数字微流控技术与 CRISPR 信号放大系统深度融合,打造出 DDA(Dual-Digital immuno Assay)全自动检测平台,实现三大核心突破:
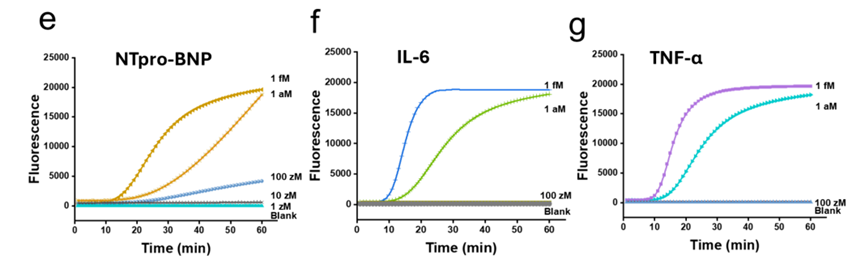
1.灵敏度跨维跃升:检测极限直达 zeptomolar(zM,10⁻²¹ mol/L)级别,对关键蛋白标志物的检测限低至 100 zM,较主流商用超灵敏检测技术提升超 100 倍,能精准捕捉疾病早期 “蛛丝马迹”,相关性能验证数据可参考原文图 2e-g 中不同标志物在极低浓度下的荧光信号变化。
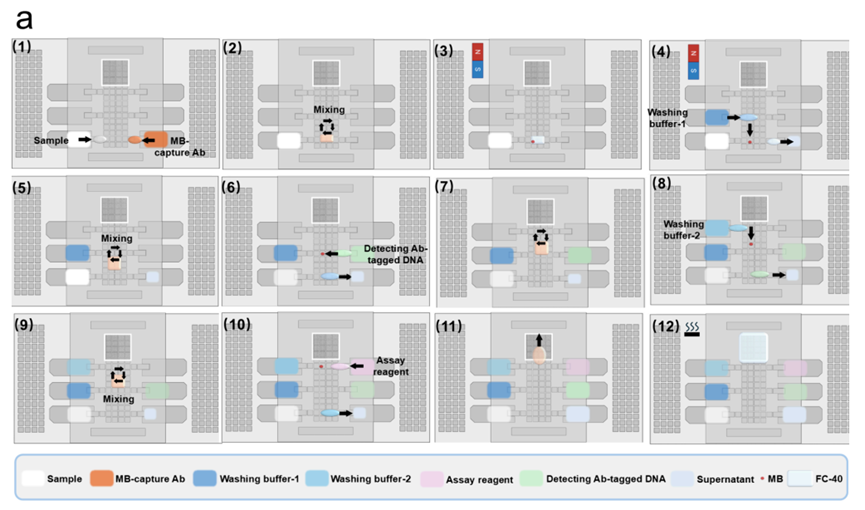
2.全流程自动化:实现 “样本进,答案出” 的极简 workflow,从免疫捕获、多步洗涤到信号放大、数字读数,全程无需人工干预,1 小时内即可完成检测,彻底解决传统方法操作繁琐、人工操作误差大的痛点,具体流程通过原文图 4a 的 12 步自动化 workflow 直观理解。
3.复杂样本兼容强:在临床血清样本中直接实现对心衰相关标志物 NT-proBNP(LOD:1 aM)、IL-6(LOD:1.5 aM)、TNF-α(LOD:2.5 aM)的精准定量,抗干扰能力突出,无需复杂样本预处理,临床样本检测结果对比见原文图 6b-e。
三、研究方法:DropletBot®赋能 “双数字”,解锁单分子检测密码
DDA 平台实现 zeptomolar 级灵敏度,主要依托 DropletBot®数字微流控与 CRISPR 信号放大体系的协同作用。整体技术路线可概括为“三个关键检测技术模块 + 一条全自动闭环流程”,共同完成从目标蛋白捕获到单分子数字化读出的全过程。
(一)三个关键检测技术模块:构建检测 “硬骨架”
1. DropletBot®数字微流控芯片:芯片采用高密度微孔阵列结构,并结合疏水 / 亲水区域精细调控的表面工程,实现纳升级液滴的精确可编程操控。芯片上集成数量级为 10⁶ 的微孔,每个微孔直径约 3.5 μm,可容纳一颗直径约 2 μm 的功能化磁珠。在外加磁场与重力共同作用下,磁珠被高效富集并单颗定位于微孔内,单孔单珠装载效率超过 90%。该设计在芯片表面构建了数量可观、彼此独立的微反应单元,为后续的单分子分离与计数提供了重要物理基础(见原文图 3a–f)。
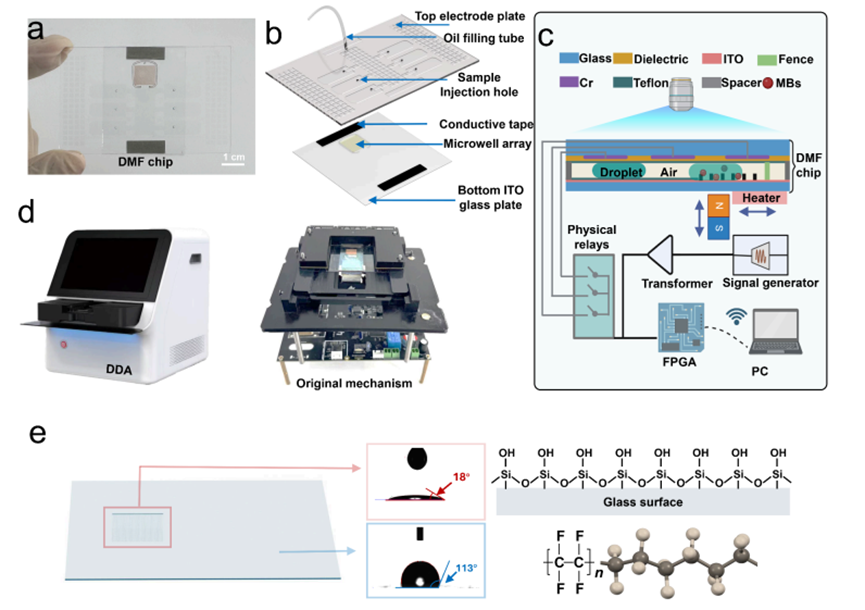

2.磁珠免疫捕获系统:通过磁珠偶联捕获抗体,高效富集样本中的目标蛋白;检测抗体则标记含 T7 启动子的双链 DNA(dsDNA)条形码,形成 “捕获抗体 - 目标蛋白 - 检测抗体 - DNA 标签” 的三明治免疫复合物,将原本的蛋白识别事件转化为可放大的核酸信号事件(原理示意见原文图 2a)。该步骤为后续 CRISPR 介导的信号放大奠定了分子基础。
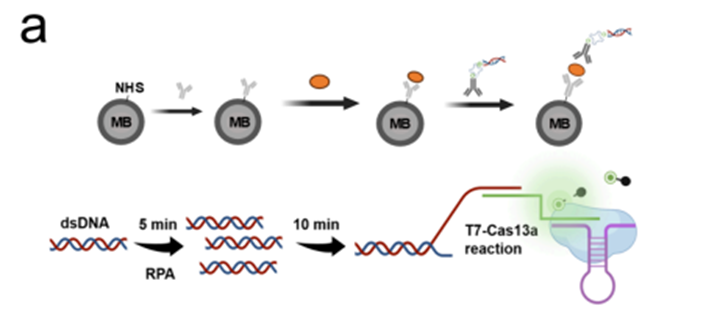
3. RPA–T7–Cas13a 级联信号放大模块。免疫复合物形成后,DNA 标签作为模板依次经历重组酶聚合扩增(RPA)与 T7 RNA 聚合酶转录,快速生成大量单链 RNA。随后,这些 RNA 触发 CRISPR/Cas13a 的 collateral cleavage 活性,对体系中的荧光 RNA 报告分子进行非特异性切割,从而产生显著增强的荧光信号。该级联体系使得单个目标蛋白即可触发强度足以在单微孔尺度被稳定识别的“放大量级”信号(见原文图 2a、2c)。
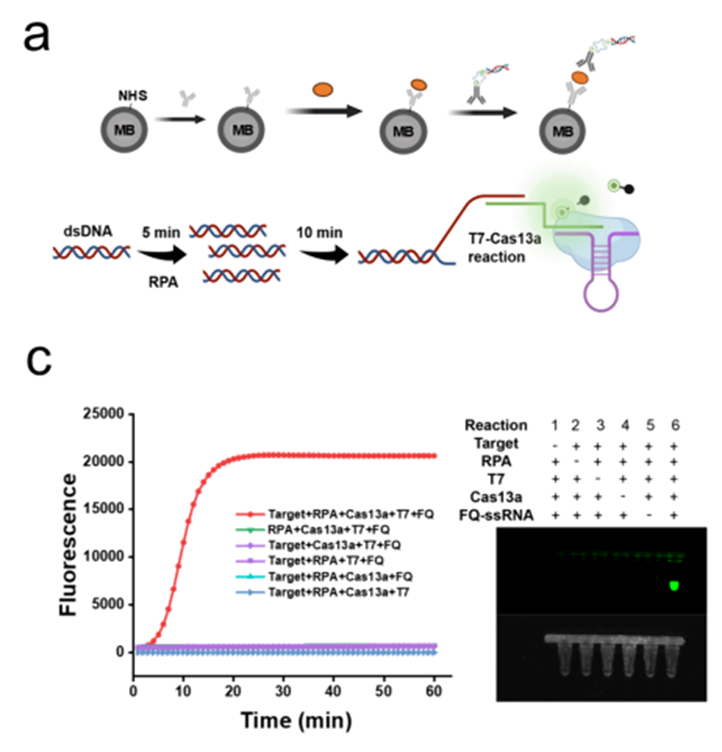
(二)全自动闭环流程:DropletBot®打通检测 “全链路”
在上述三大检测模块基础上 ,DropletBot®将各步骤集成为一条全自动闭环检测流程。检测流程起始于样本与负载捕获抗体的磁珠液滴的混合,目标蛋白在液滴中被特异性结合;其后,数字微流控系统按照预设程序自动完成两轮洗涤,以最大限度去除未结合蛋白和游离试剂,降低背景噪音。随后,系统加入带有 DNA 条形码的检测抗体,使完整三明治免疫复合物在磁珠表面完成组装;在此基础上注入 RPA–T7–Cas13a 反应体系,并将载有磁珠的液滴转移至高密度微孔阵列区域。通过氟油封装,各微孔被隔离为互不干扰的独立微反应器。经温度与反应时间优化后的恒温孵育(见原文图 4a–c)结束后,芯片进入成像系统,通过荧光图像直接统计阳性与阴性微孔数量,实现真正意义上的数字化定量分析。


概言之,DropletBot®提供精确的液滴与微孔操控框架,磁珠免疫体系实现目标蛋白的特异富集与信号转码,RPA–T7–Cas13a 级联放大则将单分子事件转化为可被稳健读取的数字信号,三者共同构成 DDA 平台的单分子检测技术基础。
四、实验结果:性能评估与临床样本验证 在上述技术架构支持下,DDA 平台在基础分析性能以及临床样本检测两方面均展示出优异表现。
(一)基础分析性能卓越
1.灵敏度:
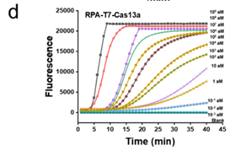
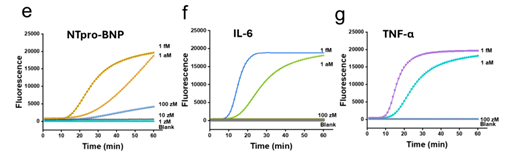
图2
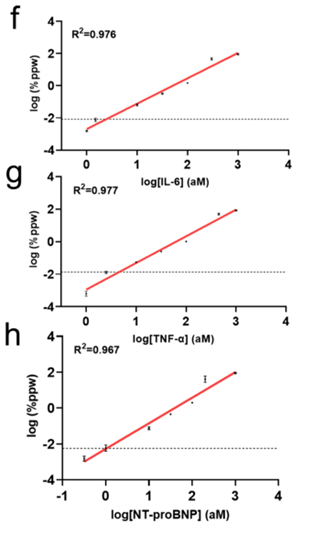
图5
2.特异性:对非目标蛋白(如 IL-1、AFP 等)无交叉反应,阴性样本背景荧光与空白对照无显著差异;
3.线性范围:DDA 的定量动态范围覆盖约 4–5 个数量级,从 0.1 aM 延展至 1 pM,不同标志物的剂量–反应曲线拟合相关系数 R² 均大于 0.967,能够兼顾早期极低浓度标志物监测与疾病进展期的高浓度检测需求,实现单一平台覆盖全病程样本。原文图 5f-h;
4.精密度:核心检测范围内变异系数(CV)<5%,近检测限浓度 CV<20%,远超临床检测标准。
(二)临床验证:解决实际诊断痛点
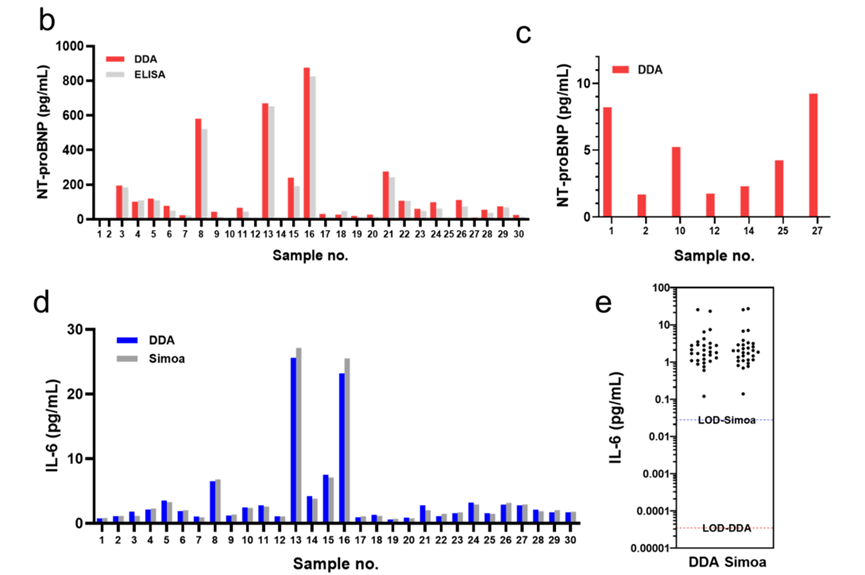
1.与商用 ELISA 对比:在 30 例临床血清样本中,DDA 成功检测出 ELISA 无法量化的低浓度 NT-proBNP 样本(如 1.68 pg/mL、1.74 pg/mL),为早期心衰诊断提供关键依据,检测结果对比见原文图 6b、c;
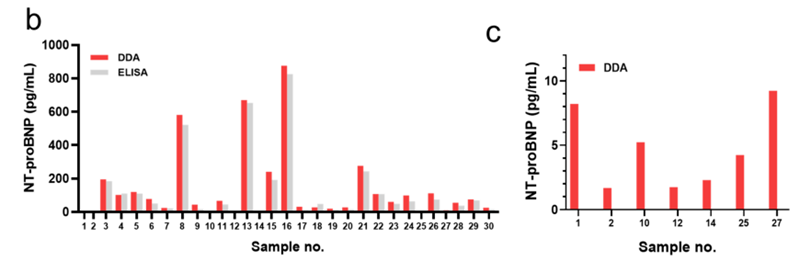
2.与超灵敏 Simoa 技术对比:检测 IL-6 时,DDA 的检测限(0.000035 pg/mL)较 Simoa(0.028 pg/mL)低 800 倍,且两者检测结果的相关系数达 0.998,在超低浓度区间展现出更优的量化能力,灵敏度对比见原文图 6d、e;这表明,在炎症尚处于亚临床水平、浓度变化极其细微的区间,DDA 具备更高的分辨能力,可用于更早、更精细地捕捉炎症状态的动态变化。

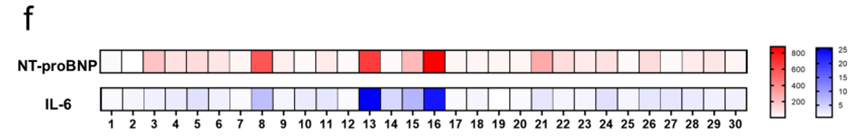
3.多标志物联合检测:同时量化 NT-proBNP(心脏应激标志物)与 IL-6(炎症标志物),揭示两者在临床样本中的协同变化模式,为复杂疾病的病理机制研究提供新工具,联合检测结果见原文图 6f。该类多参数图谱有助于更精细地区分不同病因与病程阶段,为复杂心血管疾病的分层诊疗和机制研究提供新的工具。
追光生物的DropletBot®数字微流控平台,为研究提供技术支持与实验设备,助力实现了检测效率和灵敏度的飞跃,有望在疾病诊断、药物开发等领域广泛应用,为临床实践带来新的变革。
DropletBot®数字微流控平台产品介绍:
DropletBot®数字微流控平台是一款基于介电润湿原理(EWOD)的电操控数字微流控技术(DMF)的自动化系统 ,通过改变疏水表面上液滴的接触角,精确控制电极阵列表面的离散液滴,广泛应用于生物、化学领域,如诊断、细胞实验和化学合成。DropletBot®具备模块化设计、直观用户界面,能驱动多个独立通道,并提供动态阻抗感应,实现液滴位置、速度和电静力的实时测量。

原文链接:
Unlocking Zeptomolar Single-Molecule Detection by Synergizing Digital Microffuidics and Digital CRISPR
https://doi.org/10.1021/jacs.5c15767





 粤公网安备44030002004557号
粤公网安备44030002004557号
